Ковалентная связь
Ковалентная связь – связь между атомами за счет общих электронных пар.
При сближении двух атомов водорода возможно два случая:
1. по мере сближения силы отталкивания между атомами неограниченно возрастают (кривая 1), при этом энергия системы увеличивается и система не может быть устойчивой.
2. силы отталкивания сменяются силами притяжения, которые достигают максимума при расстоянии между ядрами, равном ro (кривая 2), энергия системы в этом состоянии минимальная и меньше суммарной энергии исходных атомов.
Такое отличие в поведении атомов вызвано разными значениями спинового квантового числа для электронов в исходных атомах. Если спины электронов были одинаковыми, то это кривая 1, если разными – то 2:
Состояние, которое при этом возникает, соответствует устойчивой системе, в которой между ядрами атомов существует область с повышенной электронной плотностью. Эта область компенсирует взаимное отталкивание ядер и называется областью перекрывания орбиталей или общей электронной парой.
Так образуется молекула водорода. Так как ориентация спина электрона в атоме водорода равновероятна (половина атомов имеет электрон со спином +1/2, половина -1/2), при образовании молекулярного водорода из атомарного все атомы образуют молекулы.
Часто этот процесс изображают в виде схемы, обозначая электроны точками:
а общую электронную пару – чертой:
Ковалентная связь образуется по двум механизмам – обменному, когда каждый из участвующих в образовании связи атомов предоставляет для общей электронной пары по одному электрону (А) и донорно-акцепторный, когда донор дает электронную пару, а акцептор – свободную орбиталь (В). На рисунке приведены схемы этих механизмов и соотвествующие им реально протекающие реакции:
Образующиеся в результате молекулы ничем друг от друга не отличаются.
Полярная и неполярная ковалентная связь
По симметрии распределения заряда ковалентные связи делятся на полярные и неполярные.
Если общая электронная пара (область перекрывания орбиталей) расположена симметрично относительно связанных ядер, связь называется ковалентной неполярной, если смещена в сторону одного из ядер – ковалентной полярной.
Ковалентная неполярная связь возникает между атомами одного и того же элемента, при этом из-за симметрии распределения зарядов связь не обладает дипольным моментом. Примеры молекул с неполярной ковалентной связью: H2, O2, F2,Cl2, N2, Ag2 .
Если участвующие в образовании связи атомы отличаются по электроотрицательности, то возникает ковалентная полярная связь. Общая электронная пара смещена в сторону атома с большей электроотрицательностью, возникающая в результате асимметрия в распределении зарядов приводит к появлению у связи дипольного момента.Часто смещение электронной пары показывают стрелкой, например:
Символом обозначены дипольные заряды, которые могут
быть меньше заряда электрона, но существуют только
совместно.
Электроотрицательность атома углерода зависит от его гибридизации, в таблице для сравнения приведены относительные электроотрицательности некоторых атомов и гибридных состояний углерода:
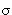 - и
- и  -связи
-связи
- и
-связи различают
по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов
проходит через область перекрывания орбиталей, связь называется
-связью, если область перекрывания
лежит в стороне от этой линии -
-связью.
-связи образуются при перекрывании s-s
орбиталей атомов (А), р-p орбиталей (В), s-p орбиталей (С) и
гибридных орбиталей:
-связи - при перекрывании р-р
орбиталей:
или р-d орбиталей:
-связь менее прочна, чем
-связь, ее электроны легче подвержены
внешнему воздействию. В соединениях с кратными связями только
одна из связей является
-cвязью,
образованная перекрыванием s, р или гибридных орбиталей, а
остальные -
-связями, образованными
перекрыванием негибридизованных р – орбиталей атомов, например,
двойная связь, образованная гибридными орбиталями (
-связь) и не участвующими в гибридизации
р-орбиталями (
-связь):
В молекулах
алкенов, в частности этилена, атомы углерода при двойнойсвязи
находятся в состоянии sp2-гибридизации, все С-Н иС-С
-связи лежат в одной плоскости,
перекрывание негибридных р-орбиталей атомов углеродапроисходит в
плоскости, перпендикулярной плоскости
-связей. Иногда эту плоскостьназывают
плоскостью
-связи:
В случае
тройной связи, например в молекулах алкинов, например,
ацетилена, атомы углерода при связи имеют sp-гибридизацию, Две
-связи, образованные перекрыванием
негибридных р-орбиталей атомов углерода ( по две от каждого)
лежат в двух взаимно перпендикулярных
плоскостях:
В таблице приведены основные характеристики связей между атомами углерода:
Водородная связь
Водородная связь образуется по донорно-акцепторному механизму между атомом водорода, соединенным с электроотрицательным атомом и атомом, имеющим неподеленную пару электронов, например:
Водород, связанный с атомом углерода, неспособен к образованию водородной связи.
Энергия водородной связи невелика (10 - 40 кДж / моль), тем не менее она в значительной степени влияет на физические и химические свойства соединений. Cоединения с межмолекулярными водородными связями имеют значительно более высокие температуры кипения, чем соединения с той же молекулярной массой, но не ассоциированные за счет водородных связей. Например, температура кипения этанола (78,3o C) значительно выше, чем температура кипения диметилового эфира (24o С). Наоборот, внутримолекулярные водородные связи могут приводить к понижению температуры кипения. Например о-салициловый альдегид (А, внутримолекулярная водородная связь) обладает большей летучестью по сравнению с п – гидроксибензальдегидом (В, межмолекулярная водородная связь ):
Образованием водородных связей объясняется растворимость многих органических соединений в полярных растворителях. Например, в водном растворе происходит гидратация низших спиртов:
Водородные связи играют огромную роль в формировании пространственной структруры белков, углеводов, нуклеиновых кислот.